CDMX.- “Ya se recibió solicitud de autorización de la vacuna (contra el COVID-19) desarrollada por Pfizer”, informó el titular de la Secretaría de Relaciones Exteriores (SRE) Marcelo Ebrard Casaubon esta noche de jueves, lo cual significa que las dosis podrían llegar pronto a México y la campaña de inmunización estaría a unos pasos de arrancar.
A través de su cuenta de Twitter el canciller dio la “buena noticia” a los y las mexicanas que se han sometido a los protocolos sanitarios desde febrero pasado, cuando se dio a conocer el primer contagio de coronavirus en el país.
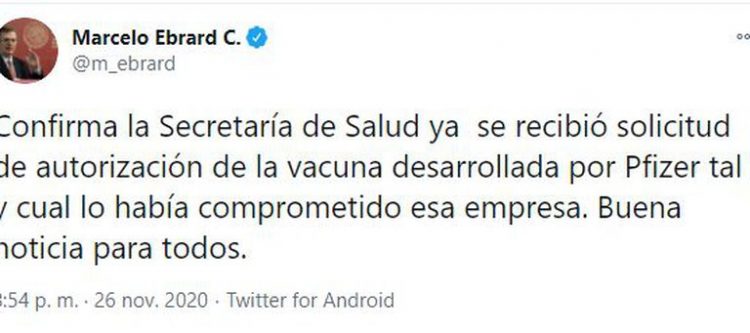
“Confirma la Secretaría de Salud ya se recibió solicitud de autorización de la vacuna desarrollada por Pfizer tal y cual lo había comprometido esa empresa. Buena noticia para todos”, festejó Ebrard Casaubón.
Tras la solicitud, la Secretaría de Salud (SSa) deberá verificar junto con la Comisión Federal para la Protección contra Riesgos Sanitarios (Cofepris), que la vacuna cumple con la garantía de seguridad y eficacia que promete la farmacéutica.
No obstante, la Cofepris será la única encargada de emitir registros autorizados a las vacunas que cumplan con todos los requisitos necesarios, pese a que los ensayos clínicos indiquen resultados favorables.
El pasado 24 de noviembre, Hugo López-Gatell, subsecretario de Prevención y Promoción de la Salud, adelantó que trabajarán arduamente para agilizar los trámites de autorización de las vacunas, sin saltarse ningún procedimiento para que el producto circule en la población.
“Tenemos que tener total claridad de los tiempos que llevan los registros y quiero declarar, para que quede sumamente claro, que una cosa es la velocidad que pueden tener los trámites y la necesidad de que los trámites sean expeditos, y la instrucción del Presidente y el compromiso de todos sus subalternos de que ningún aspecto de la burocracia haga lento el proceso”, apuntó desde Palacio Nacional.
“Pero punto y aparte están los procedimientos técnicos necesarios para verificar la evidencia. Unos están en manos de las propias compañías, que evidencia sea publicada, hacerla del conocimiento de la autoridad sanitaria de México y por supuesto se someta a la verificación de parte de comité científicos competentes”, añadió López-Gatell.
En una situación similar se encuentra Estados Unidos con Pfizer, pues esta última presentó su expediente clínico a la Administración de Medicamentos y Alimentos de Estados Unidos (FDA, por sus siglas en inglés) el pasado 20 de noviembre, y se espera que tenga respuesta el 10 de diciembre.
Lo anterior es de relevancia, ya que el resultado sería un elemento a considerar dentro los escenarios que podría tener México ante la vacuna.
Se estima que una vez que la Cofepris otorgue el registro de verificación a Pfizer, la Secretaría de Salud, “de manera exclusiva y no compartida por ley, o por múltiples leyes incluida la ley Orgánica de la Administración Pública Federal”, establezca las condiciones necesarias que garanticen que los productor son de calidad, seguros y eficaces.
Pfizer por su parte, el pasado 20 de noviembre comunicó a la prensa que la fase 3 del estudio de su vacuna demostró que su efectividad era del 95 por ciento.
Cabe recordar que recientemente el canciller señaló que México estaba listo iniciar su campaña de vacunación antes del fin de este diciembre. Además, resaltó el hecho de que el país estará preparado para recibir el medicamento al mismo tiempo que en la Unión Europea.
“La Unión Europea está lista para iniciar vacunación antes del fin de diciembre. México también”, tuiteó el canciller.
Cómo ha mencionado anteriormente López-Gatell, en cuanto la vacuna contra el COVID-19 esté en México, la primera línea en ser inmunizada será el personal de salud, junto con población vulnerable. Asimismo, se estima que estas dosis solo cubra un pequeño porcentaje de la ciudadanía. (Agencias)